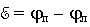Определение электродных потенциалов металлов
Электродные потенциалы экспериментально определяют, измеряя напряжение гальванического элемента, составленного из исследуемого и электрода сравнения, потенциал которого известен. Схему элемента, в котором электродом сравнения является водородный электрод, записывают следующим образом: слева — водородный электрод, справа — измеряемый электрод.
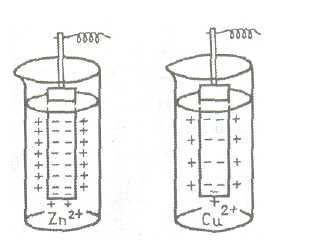
Например, схема гальванического элемента для измерения потенциала цинкового электрода имеет вид:
H2, Pt | H + || Zn 2+ | Zn,
а схема элемента для измерения потенциала медного электрода:
H2, Pt | H + || Cu 2+ | Cu,
напряжение гальванического элемента равно разности потенциалов правого и левого электродов:
Так как потенциал левого электрода условно принимают равным нулю, то напряжение измеряемого элемента будет равно потенциалу правого электрода для водородно-цинкового элемента с обратным знаком:
т.е. водородный электрод будет катодом, а – цинковый анодом, во внешней цепи электроны будут перемещаются от цинкового электрода к водородному. Для медно-водородного электрода:
медный электрод заряжен, относительно водородного, более положительно. Таким образом, во внешней цепи электроны перемещаются от водородного электрода к медному.
Теперь, зная потенциалы цинкового и медного электродов, можем рассчитать напряжение для элемента Даниэля-Якоби:
9.3.7. Стандартные значения электродных потенциалов металлов. Ряд «напряжений»
Стандартные электродные потенциалы металлических электродов в водных растворах приведены в справочной литературе. Величины стандартных ЭП металлов являются мерой восстановительной способности их атомов и мерой окислительной способности ионов металлов. Чем более отрицательное значение имеет потенциал системы Ме/Ме n+ , тем более сильной восстановительной способностью обладает атом. И наоборот, чем более положителен потенциал металлического электрода, тем более сильной окислительной способностью обладают его ионы. Например, к наиболее сильным восстановителям (в водном растворе) относится литий (ЕLi+/Li0 = -3,04 B), а к наиболее сильным окислителям — ионы золота Au 3+ , Au + (ЕAu3+/Au0 = +1,50 B, ЕAu+/Au0 = +1,69 B).
В таблице 9.1. приведены значения некоторых стандартных электродных потенциалов.
Полученный ряд значений получил условное название «ряд напряжений». В этом ряду металлы располагаются по мере уменьшения металлических свойств.
Таблица 9.1. Стандартные электродные потенциалы металлов.
Источник
Электродный потенциал. Измерение электродных потенциалов



Электрохимические системы
Общая характеристика
Электрохимия — раздел химии, которая изучает процессы возникновения разности потенциалов и превращение химической энергии в электрическую (гальванические элементы), а также осуществление химических реакций за счет затраты электрической энергии (электролиз). Эти два процесса, имеющие общую природу нашли широкое применение в современной технике.
Гальванические элементы используются как автономные и малогабаритные источники энергии для машин, радиотехнических устройств и приборов управления. При помощи электролиза получают различные вещества, обрабатывают поверхности, создают изделия нужной формы.
Электрохимические процессы не всегда служат на пользу человеку, а иногда приносят большой вред, вызывая усиленную коррозию и разрушение металлических конструкций. Чтобы умело использовать электрохимические процессы и бороться с нежелательными явлениями, их надо изучить и уметь регулировать.
Причиной возникновения электрохимических явлений служит переход электронов или изменение степени окисления атомов веществ, участвующих в электрохимических процессах, то есть окислительно-восстановительные реакции, протекающие в гетерогенных системах. В окислительно-восстановительных реакциях электроны непосредственно переходят от восстановителя к окислителю. Если процессы окисления и восстановления пространственно разделить, а электроны направить по металлическому проводнику, то такая система будет представлять собой гальванический элемент. Причиной возникновения и протекания электрического тока в гальваническом элементе является разность потенциалов.
Электродный потенциал. Измерение электродных потенциалов
Если взять пластину какого либо металла и опустить ее в воду, то ионы поверхностного слоя под действием полярных молекул воды отрываются и гидратированными переходят в жидкость. В результате такого перехода жидкость заряжается положительно, а металл отрицательно, поскольку на нем появляется избыток электронов. Накопление ионов металла в жидкости начинает тормозить растворение металла. Устанавливается подвижное равновесие
Ме 0 + mН2О = Ме n + × m H2O + ne —
Состояние равновесия зависит как от активности металла так и от концентрации его ионов в растворе. В случае активных металлов, стоящих в ряду напряжений до водорода, взаимодействие с полярными молекулами воды заканчивается отрывом от поверхности положительных ионов металла и переходом гидратировнных ионов в раствор (рис. б). Металл заряжается отрицательно. Процесс является окислением. По мере увеличения концентрации ионов у поверхности становится вероятным обратный процесс — восстановление ионов. Электростатическое притяжение между катионами в растворе и избыточными электронами на поверхности образует двойной электрический слой. Это приводит к возникновению на границе соприкосновения металла и жидкости определенной разности потенциалов, или скачка потенциала. Разность потенциалов, возникающую между металлом и окружающей его водной средой, называют электродным потенциалом.При погружении металла в раствор соли этого металла равновесие смещается. Повышение концентрации ионов данного металла в растворе облегчает процесс перехода ионов из раствора в металл. Металлы, ионы которых обладают значительной способностью к переходу в раствор, будут заряжаться и в таком растворе положительно, но в меньшей степени, чем в чистой воде.
Для неактивных металлов равновесная концентрация ионов металла в растворе очень мала. Если такой металл погрузить в раствор соли этого металла, то положительно заряженные ионы выделяются на металле с большей скоростью, чем происходит переход ионов из металла в раствор. Поверхность металла получит положительный заряд, а раствор отрицательный из-за избытка анионов соли. И в этом случае на границе металл — раствор возникает двойной электрический слой, следовательно, определенная разность потенциалов (рис. в). В рассмотренном случае электродный потенциал положительный.
Рис. Процесс перехода иона из металла в раствор:

а – равновесие; б – растворение; в – осаждение
Потенциал каждого электрода зависит от природы металла, концентрации его ионов в растворе и температуры. Если металл опустить в раствор его соли, содержащей один моль-ион металла на 1 дм 3 (активность которого равна 1), то электродный потенциал будет постоянной величиной при температуре 25 о С и давлении 1 атм. Такой потенциал называется стандартным электродным потенциалом (Е о ).
Ионы металла, имеющие положительный заряд, проникая в раствор и перемещаясь в поле потенциала границы раздела металл-раствор, затрачивают энергию. Эта энергия компенсируется работой изотермического расширения от большей концентрации ионов на поверхности к меньшей в растворе. Положительные ионы накапливаются в приповерхностном слое до концентрации со, а затем уходят в раствор, где концентрация свободных ионов с. Работа электрического поля ЕnF равна изотермической работе расширения RTln(сo/с). Приравняв оба выражения работы можно вывести величину потенциала
где Е – потенциал металла, В; R – универсальная газовая постоянная, Дж/моль К; Т – температура, K; n – заряд иона; F – число Фарадея; с – концентрация свободных ионов;
со– концентрация ионов в поверхностном слое.
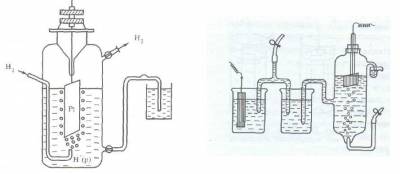
Непосредственно измерить величину потенциала не представляется возможным, так как невозможно экспериментально определить со. Опытным путем определяют величины электродных потенциалов относительно величины другого электрода, потенциал которого условно принимают равным нулю. Таким стандартным электродом или электродом сравнения является нормальный водородный электрод (н.в.э.). Устройство водородного электрода показано на рисунке. Он состоит из платиновой пластинки, покрытой электролитически осаждённой платиной. Электрод погружен в 1М раствор серной кислоты (активность ионов водорода равна 1 моль/дм 3 ) и омывается струей газообразного водорода под давлением 101 кПа и Т = 298 К. При насыщении платины водородом на поверхности металла устанавливается равновесие, суммарный процесс выражается уравнением
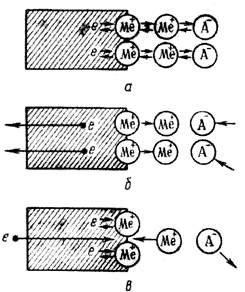
Если пластинку металла, погруженного в 1М раствор соли этого металла, соединить внешним проводником со стандартным водородным электродом, а растворы электролитическим ключом, то получим гальванический элемент (рис. 32). Электродвижущая сила этого гальванического элемента будет являться величиной стандартного электродного потенциала данного металла (Е о ).
Схема измерения стандартного электродного потенциала
относительно водородного электрода
Взяв в качестве электрода цинк находящийся в 1 М растворе сульфата цинка и соединив его с водородным электродом, получим гальванический элемент, схему которого запишем следующим образом
В схеме одна черта означает границу раздела между электродом и раствором, две черты – границу между растворами. Анод записывается слева, катод справа. В таком элементе осуществляется реакция Zn о + 2H + = Zn 2+ + Н2, а электроны по внешней цепи переходят от цинкового к водородному электроду. Стандартный электродный потенциал цинкового электрода (-0,76 В).
Взяв в качестве электрода медную пластинку, при указанных условиях в сочетании со стандартным водородным электродом, получим гальванический элемент
В этом случае протекает реакция: Cu 2+ + H2 = Cu о + 2H + . Электроны по внешней цепи перемещаются от водородного электрода к медному электроду. Стандартный электродный потенциал медного электрода (+0,34 В).
Источник
Стандартные электродные потенциалы металлов



В 1865 г. (т.е. за 4 года до открытия Д.И. Менделеевым переодического закона) металлы уже были классифицированы по их активности. Это сделал известный русский ученый Н.Н. Бекетов, который изучал действие различных металлов на разбавленные кислоты и воду и заметил, что наиболее активно ведут себя щелочные металлы. Некоторые же металлы, такие, как Cu, Hg, Ag, Au, вообще не вытесняли водород из растворов кислот, даже наоборот — водород сам способен вытеснять металлы из солей ртути и серебра.
Итогом трудов Н.Н. Бекетова явился так называемый вытеснительный ряд металлов:
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
Все металлы, стоящие в этом ряду левее водорода, вытесняют водород из разбавленных кислот.
Современное название этого ряда — «Электрохимический ряд напряжений», так как положение каждого металла в этом ряду определяется величиной так называемого электродного потенциала.
Что же такое электродный потенциал? Как он возникает?
Напомним, что электрическим потенциалом называют величину, соответствующую энергии, которую нужно затратить (и тогда потенциал положителен) или которую можно получить (и тогда потенциал отрицателен) при переносе единицы электричества из бесконечности в данную точку.
Согласно современным представлениям, в узлах кристаллических решеток металлов находятся атомы и ионы, причем нейтральных атомов очень мало, подавляющее число частиц находится в виде ионов. Электроны, подчиняясь законам квантовой теории, движутся в поле положительных зарядов, создавая своеобразный «электронный газ». Таким образом, в металле существует подвижное равновесие, которое можно выразить уравнением.
Если погрузить пластинку металла в воду, то под действием полярных молекул воды часть катионов перейдет в жидкость Me z + + mH2O ? [Me(H2O)m] z+ , а электроны останутся на пластинке металла, в результате чего металл зарядиться отрицательно.
Катионы, перешедшие в жидкость, располагаются вблизи поверхности отрицательно заряженной пластинки металла, в результате чего образуется двойной электрический слой, что схематически можно представить так (рис.1):
Рис.1. двойной электрический слой на границе металл–вода
Таким образом, на границе соприкосновения жидкости с металлом электрический потенциал? резко изменяется и наблюдается скачок (или разность) потенциала ??, который принято называть электродным потенциалом.
. В большинстве современной химической литературы скачки потенциалов обозначаются просто ?.
Ясно, что чем активнее металл, тем легче будут диссоциировать его атомы, тем большее количество катионов перейдет в жидкость и тем, следовательно, б?льшим будет отрицательный заряд металла, что, в свою очередь, обусловит б?льшую разность потенциалов на границе металл—жидкость.
Процесс перехода ионов металла в жидкость является обратимым процессом. Поэтому, если погрузить пластинку металла не воду, а в раствор соли этого металла, то равновесие будет смещено: из металла в раствор будет переходить меньше ионов и разность потенциалов на границе металл—раствор будет несколько иной, чем в первом случае.
На рис. 2. представлена схема возникновения двойного электрического слоя в случае цинковой и медной пластинок, погруженных в растворы их солей.
Рис.2. Схема возникновения электродного потенциала
Видно, что величина электродного потенциала определяется прежде всего природойметалла. Кроме того она зависит от температуры, концентрации раствора и других факторов. Поэтому для сравнения электродных потенциалов необходимо выбрать некоторые стандартные условия. Обычно сравнение производят при 25°С, давлении 101,3 кПа и в растворе с концентрацией одноименного иона, равной единице (1 моль/л).
Таким образом, стандартным электродным потенциалом называется электродный потенциал при концентрации иона металла 1 моль/л.
Абсолютное значение электродного потенциала измерить невозможно (поскольку введение любых измерительных зондов неизбежно приводит к появлению новой контактной разности потенциалов). Вместе с тем не представляет труда измерение величины относительного электродного потенциала.

Относительные электродные потенциалы металлов измеряют относительно стандартного водородного электрода, потенциал которого произвольно принят за нуль.
Поскольку водород при температуре 298 К является газом, из него невозможно, как из металла, изготовить пластинку. В качестве твердой фазы в стандартном водородном электроде используют инертный металл (например, Pt).
Конструктивно водородный электрод (рис.3) состоит из платиновой пластинки, покрытой слоем мелкозернистой платины — платиновой чернью, частично погруженной в раствор кислоты с концентрацией ионов водорода, равной 1 моль/л. Обычно берут раствор нелетучей кислоты — серной H2SO4 или хлорной HClO4. К пластинке подают чистый газообразный водород под постоянным давлением 101,3 кПа.
Возникновение потенциала на стандартном водородном электроде можно представить следующим образом. Газообразный водород, адсорбируясь платиной, переходит в атомарное состояние, поэтому в поверхностном слое платины устанавливается равновесие Н2 ? 2Н, а на границе платины и раствора серной кислоты — равновесие Н ? Н + + е.
Суммарный процесс выражается уравнением:
Таким образом, водородный электрод можно обозначить как Н2/Н + , Pt, где вертикальная черта означает поверхность раздела фаз.
Рис. 3. Схема водородного электрода или так
Если пластинку некоторого металла, погруженную в раствор его соли с концентрацией иона металла 1 моль/л, соединить электролитным мостиком с водородным электродом (рис.3), то получится гальванический элемент, т.е. в полученной системе пойдет электрический ток, обусловленный разностью электродныхпотенциаловводородногоэлектродаи изучаемогометалла.
Вот эту величину — разность электродных потенциалов катода и анода — в разомкнутом (незамкнутом) гальваническом элементе называют электродвижущей силой (ЭДС или Е) элемента:
ЭДС= ??1 –??2 или ЭДС = ??к –??А
В замкнутом гальваническом элементе, т.е. при измеряемом значении силы тока в элементе (т.е. при соединении платины с некоторым металлом металлическим проводником) разность потенциалов катода и анода называют напряжением:
Прямым измерением разности потенциалов на клеммах гальванического элемента с помощью обычного вольтметра можно получить значение напряжения U,которое не равноЭДСэлемента, т.е. U 0 , ВK, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
(или просто ? 0 ) –2,92 –2,38 0,0 0,8 1,2
Ряд напряжений характеризует химические свойства металлов:
1. Чем меньшей алгебраической величиной ? 0 обладает металл, тем он химически активнее, т.е. тем больше его восстановительная способность.
2. Чем дальше расположены друг от друга в ряду напряжений два металла, тем б?льшую электродвижущую силу будет иметь построенный из них гальванический элемент, причем катодом всегда будет являться тот электрод, потенциал которого больше.
Источник